Au repos, on considère que le muscle est soumis à une tension de base appelée tonus musculaire. L'augmentation de cette tension de repos est appelée hypertonie musculaire. La spasticité est une variété particulière d'hypertonie musculaire. En pratique, cette hypertonie se manifeste par une augmentation de la résistance du muscle à l'étirement.
Deux courants s' affrontent quant aux mécanismes physiopathologiques de la spasticité. Ils sont probablement complémentaires :
La spasticité est une contraction réflexe, c'est à dire involontaire, d'un groupe musculaire à son propre étirement, ce que rappelle l'éthymologie : en grec, spao (spaw) signifie : "je contracte".
Définition selon LANCE (1980) : "Spasticity is a motor disorder characterized by a velocity-dependent increase in tonic stretch reflexes (muscle tone) with exaggerated tendon jerks, resulting from hyperexcitability of the stretch reflex, as one component of the upper motor neuron syndrome".
La définition de DELWAIDE (1993) ajoute quelques éléments cliniques et physiologiques : " Spasticity is a motor disorder characterized by brisk tendon jerks (sometimes accompagnied by clonus) and a velocity-dependent elastic muscle hypertonia during stretch, affecting certain muscle groups preferentially. It results from hyperexcitability of the Ia pathways to motor neurons combined with abnormal processing at the spinal cord level of other peripheral afferents inputs (tonic stretch reflex) ".
1-1-1-1 Généralités:
Il peut être assimilé à un système d'asservissement réglant en permanence certaines caractéristiques (longueur, voire raideur) du muscle. C'est un réflexe dit "proprioceptif", car le stimulus auquel il est sensible est l'étirement musculaire. Il permet, d'une part de maintenir en permanence un "tonus de posture" indispensable à la position érigée, et d' autre part, de lisser la cinématique du mouvement volontaire (concept de servo-assistance), en collaborant étroitement à sa réalisation.
On décrit à ce réflexe une composante "phasique", plus marquée dans les muscles fléchisseurs, et s'exprimant lors des étirements à vitesse rapide (exemple : percussion des réflexes ostéo-tendineux), et une composante "tonique", dominante dans les muscles extenseurs des membres inférieurs (muscles posturaux, ou antigravifiques, s' opposant à la pesanteur), qui se manifeste lors des étirements à vitesse plus lente ou étirements continus. C'est l'exagération de la composante tonique qui est rendue responsable du phénomène spastique.
1-1-1-2 Organisation élémentaire
Le réflexe d'étirement est organisé au niveau segmentaire ("tranche" de moelle épinière intégrant des afférences sensitives et produisant des efférences motrices, dans un territoire bien déterminé ou métamère, possédant une certaine autonomie), et pluri segmentaire (superposition d' un certain nombre de métamères adjacents), mais aussi à un niveau supra-spinal, grâce à la participation des centres nerveux, dont il reçoit une puissante régulation (facilitatrice ou inhibitrice).
1-1-1-3 La boucle myotatique
Comme tout système réflexe, la réponse musculaire à l'étirement est organisée en boucle (figure 1):
Figure 1: 
Les éléments principaux de la boucle réflexes sont :
* des organes récepteurs spécialisés, les fuseaux neuro-musculaires (sensibles à la vitesse d'étirement du muscle, ainsi qu'à l'amplitude de l'étirement .
* qui donnent naissance à des afférences primaires (fibres Ia), et secondaires (fibres II)
* se projetant sur les alpha-motoneurones de la CA de la moelle. Ceux-ci réagissent au stimulus en provoquant la contraction des fibres musculaires sous leur dépendance. Cette contraction réflexe s' oppose à l'étirement initial. La correction ainsi apportée est proportionnelle à la variation (de longueur ou de vitesse) provoquée par l'étirement, mais peut être modulée par les centres nerveux supra-spinaux, modifiant ainsi l'amplitude de mouvement autorisée.
* le gamma-motoneurone spinal participe également à cette modulation. Il est capable de modifier le gain du fuseau neuromusculaire, grâce à son action fusimotrice (contraction des fibres intrafusoriales, modifiant la sensibilité du récepteur fusorial). Il est également soumis à la régulation supra-spinale.
- l'organe récepteur est un mécanorécepteur tendineux (organe de GOLGI ou autre mécanorécepteur tendineux), sensible à la tension. Son seuil d'excitation est plus élevé (environ 30 fois plus) que celui des fuseaux neuromusculaires, mais il s'abaisse considérablement lorsqu'il existe une contraction musculaire, volontaire ou réflexe.
- la transmission du message proprioceptif est assuré par des fibres Ib,
- qui viennent faire synapse, de façon indirecte, par l' intermédiaire d'un interneurone (circuit disynaptique), avec l'alpha motoneurone correspondant.
Figure 2 :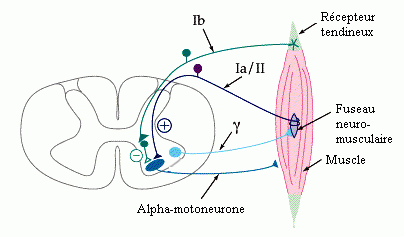
Le résultat est une dépression de l' activité de celui-ci, soit une diminution de la tension du muscle, visant à protéger l'unité myo-tendineuse. Alors que le réflexe myotatique est un système d'asservissement du muscle en longueur, le réflexe inverse est un mécanisme d'asservissement en tension.
1-1-1-5 Autres afférences
Enfin, il existe de nombreuses autres afférences (proprioceptives articulaires, extéroceptives cutanées, nociceptives ...), non impliquées à proprement parler dans la spasticité, mais partageant une partie du pool des interneurones médullaires impliqués dans la boucle myotatique. Ceci rend possible des interactions entre diverses boucles réflexes (Ex : exagération de la spasticité par les stimuli nociceptifs : "épines irritatives").Ces interneurones reçoivent également les influences des centres nerveux supérieurs, et sont ainsi des relais majeurs de la régulation supra-spinale. Ils voient converger vers eux les influx périphériques et les signaux de régulation supraspinaux (Lundberg 1979). Il faut envisager le pool des interneurones spinaux comme une sorte de "voie finale commune" pour de nombreux faisceaux descendants, capables de coordonner et de contrôler les activités descendantes, segmentaires ou propriospinales, et fonctionnant comme de véritables centres d'intégration prémoteurs organisés en réseau (figure 3).
Figure 3 :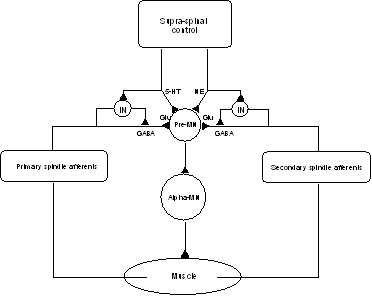
1-1-1-6 Organisation segmentaire
A l'étage segmentaire, le mouvement est organisé autour d'un couple "agoniste-antagoniste" (par exemple extenseur-fléchisseur), réalisant une unité neuromotrice fonctionnelle qui s'articule autour des deux boucles myotatiques associées au couple de groupes musculaires correpondant, grâce à des interneurones qui en assurent la jonction (interneurones Ia en particulier). Ainsi, lors de la contraction d'un muscle (par exemple l'extenseur), l'antagoniste (ici le fléchisseur) se relâche, et inversement : c'est l'inhibition réciproque (figure 4). Son rôle est avant tout d'empêcher que le mouvement produit par la contraction de l'antagoniste ne déclenche un réflexe myotatique dans le muscle étiré. Les interneurones de l'inhibition réciproque sont eux aussi soumis à une puissante régulation supraspinale.
Figure 4 : 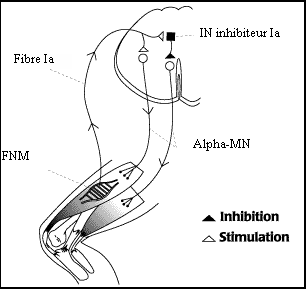
Il existe enfin des interneurones excitateurs. Par exemple, une partie des influx Ia est transmise aux motoneurones par l'intermédiaire de circuits oligosynaptiques (di ou tri-synaptiques) dont les interneurones excitateurs paraissent surtout chargés de transmettre la commande descendante aux motoneurones. En cas de lésion du système nerveux central, ce système propriospinal (Pierrot-Deseilligny) serait plutôt impliqué dans la physiopathologie de la difficulté de commande volontaire que dans celle de la spasticité. Il posséderait également un rôle dans la récupération fonctionnelle. Ces circuits confèrent à la moelle spinale des capacités d'intégration et de programmation motrices non négligeables et illustre le concept de générateur spinal de marche (voir ci-dessous).
1-1-1-7 Organisation plurisegmentaire
L' organisation segmentaire que nous avons décrite est répétée à chaque étage médullaire. L'association fonctionnelle de plusieurs étages entre eux permet à la moelle de gérer seule certaines combinaisons motrices simples. Y collaborent les projections Ia hétéronymes, en particulier celles qui unissent des muscles agissant sur des articulations différentes. Elles semblent avoir évolué pour assurer les co-contractions de muscles synergiques au cours d'activités automatiques comme la marche.
Il existe à ce propos des exemples issus de l'observation clinique comme la synergie entre les extenseurs de la cheville et les extenseurs du genou, les pronateurs de l'avant-bras et les fléchisseurs du coude, mais aussi les extenseurs du coude et du genou. Ces connexions sont responsables en pathologie des syncinésies de coordination et rendent peut-être également compte de la diminution de la spasticité sur la totalité d'un membre ou même d'un hémicorps après traitement électif d'un muscle " gâchette ". Il existe des associations bien plus élaborées, semblant matérialiser de véritables "sous-programmes" moteurs intégrés au niveau spinal. Deux systèmes anatomiques complexes de ce type ont pu être documentés : le générateur spinal de marche (chez l'animal), et le système propriospinal C3-C4 (chez l'homme). Cette organisation plurisegmentaire pourrait avoir le rôle de parer rapidement (avec un temps de réponse nettement inférieur à celui nécessitant un relais cortical) aux imprévus environnementaux pouvant survenir lors du mouvement volontaire.
1-1-1-8 Systèmes de régulation
Depuis le XIX siècle, on considère que l'éclosion de la spasticité est la conséquence de la libération de l'activité des circuits réflexes spinaux à la suite d'une lésion supra-spinale (Sechenov 1863). Des systèmes de régulation supraspinaux permettent en effet de moduler l'activité des circuits réflexes médullaires. Ils intègrent tous des interneurones inhibiteurs :* l'inhibition présynaptique Ia
* l'inhibition de Renshaw (interneurone qui, stimulé par une collatérale d' un axone moteur, inhibe celui-ci en retour).
* l'inhibition autogénique Ib
* circuit II : l'inhibition véhiculée par les fibres du goupe II se réalise avec des effets complexes (excitateurs ou inhibiteurs), sur l'aMN homonyme. Actuellement le rôle des afférences de type II est de plus en plus jugé important dans la génération de la spasticité.
Un autre courant de recherche attribue à la raideur non réflexe, c'est à dire la raideur proprement musculaire, une part importante dans la génèse de la spasticité.
Au plan biomécanique, une part de la tension provoquée par l'étirement du muscle, même dénervé, est en effet attribuable à deux composantes mécaniques :
* une composante élastique, liée à l'existence d'un tissu conjonctif de soutien
* et une composante visqueuse.
Dans le muscle spastique la raideur non réflexe est augmentée, peu semble t-il par modification de la composante élastique, mais majoritairement à cause de l'augmentation de la viscosité (Hufschmidt 1982). Cette altération des propriétés mécaniques du muscle semble cependant bien d'origine neurogène, puiqu'il est possible, chez le chat décérébré, d'obtenir un "pseudoréflexe d'étirement", alors que toutes les racines postérieures ont été sectionnées, mais que les racines antérieures sont intactes. Ce phénomène est attribué à la modification des propriétés mécaniques du muscle quand il existe une décharge permanente des aMN (hypothèse " transsynaptique "). Ce mécanisme pourrait dépendre de la modification des fibres musculaires au cours de la spasticité, sous la forme de la transformation fibres II en fibres I (Dietz 1984).
. élasticité : longueur-dépendante
. viscosité : vitesse-dépendante
. inertie : accélération-dépendante
. plasticité : temps-dépendante (thixotropy)
. rétractions (muscles, tendons, ligaments)
. réflexes : abolis par la rhizotomie : Spasticité
. centraux : non modifiés par la rhizotomie :Selon STRUPPLER (1971) : " Nos relations conscientes avec le monde ambiant ont pour condition l'innervation tonique de notre musculature striée, soit le tonus de posture. Tout mouvement volontaire ne peut s'effectuer de façon harmonieuse que si fonctionnent automatiquement et de manière coordonnée, d'une part l'innervation statique, soit à la station debout l'innervation involontaire tendant à neutraliser les effets de la pesanteur, et d'autre part la composante dynamique du processus moteur, c'est à dire l'adéquation de la position et de la posture du corps aux influences variables du milieu ".
Les voies anatomiques impliquées dans la physiopathologie de l'hypertonie musculaire sont en celles qui jouent un rôle dans la physiologie de la posture, c'est à dire essentiellement les voies extra-pyramidales.
La voie pyramidale prend naissance au niveau des aires motrices précentrales (aires 4 et 6 de Brodman), mais également dans les aires pariétales primaires (aires 3, 1 et 2) et l'aire pariétale secondaire (aire 40). La majeure partie des fibres pyramidales se termine dans la zone intermédiaire entre les cornes ventrale et dorsale, au contact de neurones intermédiaires. Seule une toute petite partie atteint directement les motoneurones de la corne ventrale : ce sont les alphamotoneurones innervant la partie distale des membres (main). Les fibres issues du lobe pariétal se terminent dans les noyaux des cordons dorsaux de la moelle (noyaux gracile et cunéiforme), et dans la substance gélatineuse de la corne dorsale. Elles régulent les afférences sensives.
Les voies extrapyramidales sont nombreuses. Elles portent ce nom parce qu'elles ne cheminent pas dans la pyramide bulbaire, à l'inverse de la voie pyramidale. Leur origine est essentiellement sous-corticale dans les corps striés, le pallidum, le noyau sous-thalamique (corps de Luys), le noyau rouge, et la substantia nigra. On y associe d' utres structures qui ne sont pas des noyaux moteurs, mais qui ont un rôle d'intégration important (cervelet, noyaux thalamiques, formation réticulaire et noyaux vestibulaires), ainsi que certaines aires corticales (aires oculomotrices frontales et occipitales, voire certaines aires pariétales et temporales). Le faisceau central de la calotte est considéré comme la voie efférente principale. D'autres voies descendantes s'y ajoutent (faisceaux rubro, réticulo, vestibulo, interstitio-spinal …). Les voies extra-pyramidales gèrent de façon inconsciente le maintien de l'équilibre statique et de l'attitude du corps pendant les mouvements volontaires, mais aussi les mouvements automatiques complexes, appris après un exercice répété (voie rubro-spinale).
Il est possible, au niveau spinal, de distinguer deux sous-systèmes moteurs fonctionnels :un sous-système latéral, composé principalement des faisceaux rubro, réticulo et cortico-spinal, commandant notamment les mouvements de flexion des extrémités. La voie pyramidale et la voie rubro-réticulo-spinale activent en effet essentiellement les neurones des muscles fléchisseurs et inhibent les muscles extenseurs, ceci étant surtout vrai pour les muscles de la main amenés à réaliser des mouvements fins et précis.un sous-système ventro-médian, issu de structures motrices mésencéphaliques, subissant l'influence d'impulsions corticales, strio-pallidales et cérébelleuses, et servant au contrôle de la motricité ainsi qu'au maintien et à l'intégration des mouvements du tronc et des membres, donc aux fonctions posturales et locomotrices. Ce système, phylogénétiquement ancien, est destiné à lutter contre la pesanteur, en jouant un rôle important dans le maintien de l'attitude du corps et l'équilibre. Les voies qui le constituent sont le faisceau vestibulo-spinal et les fibres issues de la formation réticulaire pontique. Elles inhibent la motricité des muscles fléchisseurs et stimulent celle des muscles extenseurs (au membre inférieur).
Contrairement à une idée commune, il n'existe pas d'évidence qu'une lésion isolée de la voie pyramidale puisse être responsable à elle seule des manifestations de la spasticité musculaire. Chez l'animal, les lésions de ce type se manifestent plutôt par des signes déficitaires (diminution de la force musculaire, en particulier au niveau des mouvements fins des doigts), une hypotonie et une hyporéflexie (chez le singe) et ceci durant plusieurs mois après la survenue de la lésion causale.
Ceci ne signifie pas que le cortex cérébral n'influence pas le tonus musculaire, mais il semble que ce soient les lésions intéressant les aires prémotrices, plutôt que celles détruisant l'aire motrice primaire (aire 4), qui soient en cause (figure 5). Ainsi, il existe une plus grande incidence de la spasticité musculaire dans les lésions circoncrites du bras antérieur de la capsule interne (voie de passage des efférences provenant des aires prémotrices, fibres parapyramidales) que dans celles intéressant le bras postérieur (passage du faisceau pyramidal). Ceci permet de comprendre l'importance de la spasticité dans les lésions sous-corticales diffuses (SEP).
Figure 5 : 
L'écorce cérébrale possède en effet un puissant effet inhibiteur sur le tonus musculaire. Cet effet est relayé par la formation réticulée (figure 6), qui compte deux structures aux fonctions opposées, révélés par des expériences de stimulation électrique chez l'animal :
Figure 6 : 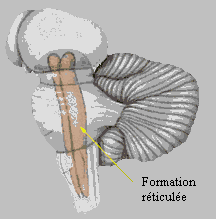
un système inhibiteur représenté par la formation réticulée bulbaire ventromédiale, qui diminue le tonus musculaire, avec à cet égard un effet facilitateur du cortex prémoteur (et une modulation possible par le cortex cérébelleux et le noyau fastigial), se projetant (par un faisceau réticulospinal dorsal) sur la moelle, et un système excitateur localisé dans la formation réticulée de la partie dorsale du tronc cérébral (connecté au locus niger), se projetant sur la moelle par un faisceau réticulospinal ventral, anatomiquement assez diffus, qui accroît le tonus. Ce système, à l'inverse du premier, ne semble pas affecté par l'activité corticale, mais plutôt par celle des noyaux gris centraux.
Figure 7 : 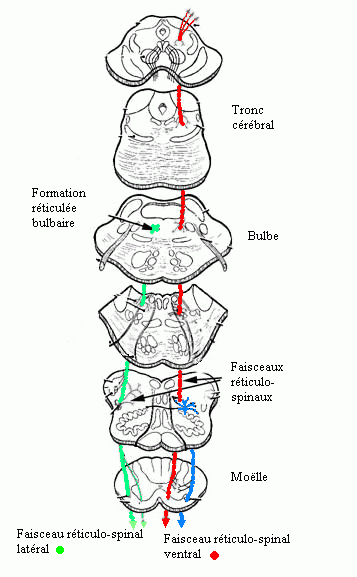
Les connaissances résumées dans les points précédents permettent d'interpréter la plupart des tableaux cliniques rencontrés en pathologie humaine. Chez l'homme, la vérification expérimentale des données collectées chez l'animal, a été apportée par la chirurgie de cordotomie, pratiquée pour des pathologies aussi diverses que la maladie de Parkinson (cordons dorso-latéraux), les douleurs chroniques (cordons latéraux), la spasticité (cordons antérieurs).En résumé, il est donc possible de proposer, chez l'homme, l'existence de deux systèmes antagonistes régulant le tonus musculaire : d'une part un faisceau réticulospinal dorsal ("dorso-latéral") inhibiteur cheminant dans la moelle dorso-latérale, topographiquement proche du faisceau pyramidal, et d'autre part un faisceau réticulospinal facilitateur, assisté d'un faisceau vestibulospinal, cheminant tous deux dans la moelle ventrale (figure 7).
La spasticité rencontrée dans les lésions encéphaliques frontales ou capsulaires internes s'explique par la diminution de l'action facilitatrice du cortex antérieur sur la formation réticulée bulbaire inhibitrice. Ainsi, au cours des lésions capsulaires internes ou corticales, des lésions conjointes de la voie pyramidale et des fibres parapyramidales destinées à la formation réticulée inhibitrice sont responsables de l'apparition du tableau d'hémiplégie spastique. La spasticité prédomine sur les extenseurs au membre inférieur, les fléchisseurs au membre supérieur.
Lors des lésions médullaires partielles, l'atteinte des voies réticulospinales inhibitrices est souvent plus marquée que celle du sous-système ventro-médian excitateur, anatomiquement plus diffus. Il apparaît donc souvent une spasticité en extension aux membres inférieurs. Les réponses en flexion sont modérées ou absentes. Ce type de tableau clinique est rencontré dans les formes spinales de Sclérose en Plaques (SEP), ou au cours des lésions médullaires traumatiques incomplètes.
Chez l'homme, l'existence de lésions touchant à la fois les voies vestibulo et réticulo spinales facilitatrices aurait un rôle dans la survenue de la spasticité en flexion. Ainsi, dans les lésions médullaires sévères ou complètes, il y a perte de toute influence supraspinale sur la moelle. La spasticité n'est pas aussi marquée que dans les lésions spinales incomplètes car les voies réticulo-spinales excitatrices sont interrompues. On observe par contre d'importantes manifestations de réponses en flexion (réflexes en flexion et spasmes en flexion). Ce tableau est volontiers rencontré dans les lésions médullaires traumatiques complètes.
3 LA SPASTICITE : DESCRIPTION CLINIQUE
3-1 Contexte de survenue
La spasticité survient lors de certaines lésions du système nerveux central (encéphale ou moelle épinière). Les pathologies les plus couramment pourvoyeuses de spasticité sont : la sclérose en plaques, l' infirmité motrice cérébrale, les traumatismes vertébro-médullaires, les accidents vasculaires cérébraux, les traumatismes cranio-encéphaliques. Très généralement chez ces patients, spasticité et déficit de la force musculaire volontaire (paralysie) sont associés, ceci s' expliquant par la proximité (et non l' identité) des voies neurologiques impliquées.3-2 Tableaux cliniques
3-2-1 Définition clinique restreinte (LANCE)
Lors de l' examen clinique, la spasticité est responsable d'une raideur musculaire, classiquement qualifiée, depuis CHARCOT, d' "élastique" (car le segment de membre que l' on mobilise tend à revenir à sa position de départ).La spasticité prédomine sur les muscles posturaux que sont, chez l'homme, les extenseurs aux membres inférieurs , et les fléchisseurs aux membres supérieurs (distribution tonique de WERNICKE-MANN).Les autres caractéristiques cliniques de la spasticité sont les suivantes :
* absence de tonus de repos : au repos, le muscle spastique ne présente aucune activité contractile, tout comme le muscle sain.
* vitesse dépendance : la résistance à l'étirement n'existe que lors d'un déplacement, et elle augmente lorsque la vitesse de mobilisation s'accroît. L'activité réflexe cède donc au repos, au contraire de ce qui existe dans les autres causes d'hypertonie musculaire (on emploie alors plus volontiers le terme de "rigidité")
* dépendance négative vis à vis de la longueur musculaire. La spasticité cède à l'étirement prolongé : c'est le phénomène du canif : quand l'amplitude de l'étirement s'accroît, la contraction réflexe s'atténue dans le muscle extenseur. Ce phénomène a été d'abord attribué à la mise en jeu des récepteurs tendineux de Golgi, puis à l'activation des afférences fusoriales secondaires, voire, plus récemment, à l'effet inhibiteur des afférences du réflexe en flexion. Il semble être absent au membre supérieur.
* fatigabilité : l'activité réflexe diminue lorsqu'on répète l'étirement musculaire, à des intervalles de temps incompatibles avec la mise en jeu de l'inhibition présynaptique. Ceci est interprété comme un épuisement progressif de l'hyperexcitabilité myotatique, lié à une déplétion synaptique en neuromédiateur.
3-2-2 Définition clinique élargie
Le tableau clinique de la spasticité peut s'enrichir de différents éléments pour atteindre, de façon hiérarchisée, une forme plus complète :
* hypertonie de repos associée,
* exagération des réflexes extéroceptifs cutanés : pour certains auteurs seulement, le terme de spasticité recouvre aussi les phénomènes de réponse en flexion , ou réflexes de défense ou de retrait (figure 8):
Il s'agit d' une réponse en flexion d'un membre, lors d' une stimulation essentiellement cutanée (extéroceptive), par exemple douloureuse (nociceptive). Ses caractéristiques physiologiques sont totalement différentes de celles du réflexe d' étirement :
- cette réponse n' intéresse que les muscles fléchisseurs,
- son intégration est purement spinale,
- le circuit réflexe est purement polysynaptique,
- ces manifestations sont à rapprocher du cadre plus large de l'automatisme médullaire (lésions spinales).
* manifestations d'accompagnement :
- syncinésies (témoins de la perte de sélectivité du mouvement, " désinhibition " des projections hétéronymes Ia)
- clonus (activité alternative des agonistes et antagonistes)
- exagération des réflexes ostéo-tendineux (à considérer plutôt comme une composante du syndrôme pyramidal)
* altération des capacités motrices par déficit et dys-coordination des commandes musculaires (perturbation de l'inhibition réciproque par exemple, avec co-contraction agoniste-antagoniste),
* voire dystonie spastique, contractures.
SPASTICITE
Contracture "tendino-réflexe"
Babinski 1912
Spasticité "PRR"
(Proprioceptive Reflex Release)
Landau, 1974
· "trouble moteur caractérisé par une augmentation vitesse-dépendante du réflexe tonique d'étirement …") LANCE, 1980
· Raideur "élastique"
· Prédomine sur les muscles posturaux (extenseurs membres inférieurs)
· Intégration spinale et supra-spinale (réflexes à longue boucle)
· Arc réflexe myotatique (mono-oligo synaptique)
· Stimulus proprioceptif (étirement)
· Lésions encéphaliques ou spinales incomplètes
· Peu sensible au baclofène, à la réfrigération et aux blocs nerveux
REPONSES EN FLEXION
Contracture "cutanéo*réflexe"
Babinski, 1912
Spasticité "GRR"
" General Reflex Release "
Landau, 1974
· Muscles fléchisseurs (réaction de défense)
· Intégration purement spinale· Voies polysynaptiques
· Stimuli extéroceptifs (nociceptifs)
· Lésions spinales complètes (automatisme médullaire)
· Sensible au baclofène, à la réfrigération et aux blocs nerveux (fibres de petit diamètre)
3-3 Evolution temporelle
La spasticité musculaire est un phénomène classiquement décrit comme éminemment variable, chez un même sujet, au cours du temps, et selon divers autres paramètres comme la température, l'état psychique et le degré de vigilance, la position, les afférences végétatives, la stimulation cutanée ... Ceci s' explique par la distribution des voies anatomiques lésées (cf. § 2-2). Cette vision classique est cependant à nuancer, et probablement plus appropriée pour les spasticités d'origine spinale avec réponses en flexion associées, ou les spasticités récentes encore évolutives. En effet, bien que l' évolution temporelle de la spasticité soit peu documentée, il semble exister une relative stabilité des spasticités chroniques d'origine encéphalique.
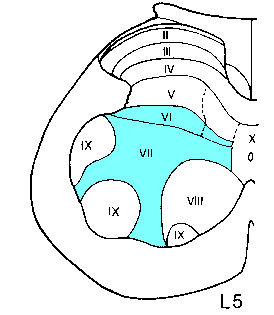
Les différents mécanismes physiopathologiques sous-tendant l'évolution temporelle de la spasticité sont mal connus. Alors que le déficit de commande motrice est immédiat après une lésion du système nerveux central, l'apparition de la spasticité est généralement différée de plusieurs semaines. L'explication de ce délai fait appel au concept de conséquences neurobiologiques évolutives d'une lésion neurologique initiale. En effet, il est généralement admis que la dégénérescence axonale qui suit une lésion entraine des remaniements de connectivité des neurones cibles déafférentés (bourgeonnement = "sprouting"). Chez le chat, Murray et Goldberger observent, à 2-3 semaines d'une hémisection spinale, une facilitation des réflexes segmentaires du côté lésé, associée à une augmentation homolatérale des projections primaires intra-spinales, essentiellement à l'intérieur des laminae recevant les voies descendantes lésées (laminae VI-VII) (figure 9).
Figure 9 :
4-1 Introduction
La spasticité est actuellement la seule composante du syndrôme pyramidal accessible à la thérapeutique.4-2 Thérapeutiques physiques
Elles comprennent :4-2-1 Les étirements musculaires
Ils possèdent une activité antispastique véritable, bien que peu durable et doivent en conséquence être répétés suffisamment souvent (au minimum plusieurs fois par jour). Le mécanisme mis en jeu n'est pas précisément connu, exploitant la "fatigabilité" du réflexe myotatique ou les phénomènes visco-élastiques musculaires.4-2-2 La stimulation électrique
Il peut s'agir d'électromyostimulation (du muscle spastique ou de son antagoniste parésié), ou de stimulation cutanée dans le dermatome correspondant aux muscles spastiques. L'efficacité est également peu durable. Les mécanismes mis en jeu sont mal connus. Au moins pour la technique d'électrostimulation cutanée, il pourrait s'agir d'un mécanisme identique à celui de la neurostimulation antalgique.4-3 Thérapeutiques médicamenteuses
Les thérapeutiques médicamenteuses sont les plus nombreuses. Leur principe est basé sur la connaissance des neurotransmetteurs impliqués dans les mécanismes de la spasticité.4-3-1 Neuropharmacologie de la spasticité
Figure 10 : 
Au niveau spinal, les neuromédiateurs excitateurs sont représentés essentiellement par les acides aminés excitateurs (AAE), mais aussi l'acétylcholine et la substance P. Les terminaisons des fibres de gros diamètre conduisant les afférences sensitives provenant de la peau et des articulations, dont les fibres Ia responsables du réflexe monosynaptique, secrétent des AAE (probablement du glutamate). Les interneurones excitateurs libéreraient de l'aspartate. Les fibres de petit diamètre semblent produire des peptides. Les circuits inhibiteurs mono et poly-synaptiques utilisent le GABA et la glycine. Le GABA est impliqué principalement dans les mécanisme d'inhibition présynaptique Ia. La glycine serait libérée par les interneurones médiant les inhibitions postsynaptiques récurrente et réciproque. Parmi les grandes voies descendantes modulant le tonus musculaire, il existe une voie extrapyramidale inhibitrice noradrenergique provenant du locus coeruleus, et une voie réticulospinale probablement sérotoninergique. Le faisceau pyramidal utiliserait le glutamate (figure 10).
4-3-2 Les molécules antispastiques
Quatre médicaments sont utilisés comme antispastiques (figure 11) : le baclofène, le diazepam, le dantrolène et la tizanidine.

Figure 11
Ces quatre médicaments appartiennent à trois classes médicamenteuses :
4-3-2-1 Les agonistes du GABA
Le GABA (g-amino-butyric-acid ou acide gamma amino butyrique) est reconnu depuis longtemps comme un médiateur de l'inhibition présynaptique
- les GABA-A agonistes sont représentés par les benzodiazépines (valium*, rivotril*, myolastan*)
- les GABA-B agonistes, représentés par le baclofène (liorésal)
4-3-2-2 Les agonistes a2 adrénergiques centraux (Catapressan*, Sirdalud*)
Ils restaurent l'inhibition noradrenergique normalement exercée par le faisceau réticulospinal dorsal sur la libération des neuromédiateurs excitateurs, au niveau spinal.
4-3-2-3 Les antispastiques d'action périphérique
Il en existe trois :
- le dantrolène (dantrium*) agit directement sur le muscle, en inhibant le couplage excitation-contraction. Il est susceptible de diminuer la force musculaire volontaire.
- la toxine botulinique (Botox*, Dysport*) permet une dénervation chimique élective et réversible d'un ou plusieurs groupes musculaires, dans le but de permettre aux muscles antagonistes parésiés, de reprendre un rôle fonctionnel. Elle agit en se fixant directement au niveau de la plaque motrice.
- les injections d'alcool ou de phénol au niveau des points moteurs détruisent les terminaisons motrices et sensitives, interrompant ainsi doublement l'arc réflexe. On peut les considérer comme des techniques agressives car douloureuses, incomplètement réversibles, et causant des lésions durables de fibrose musculaire.4-4 Thérapeutiques chirurgicales
Les neurotomies sélectives ou supersélectives permettent de ne léser que les fibres sensitives, interrompant l'arc réflexe, sans hypothéquer la motricité résiduelle. Elles s'adressent aux spasticités localisées. Leur effet est temporaire. Exemple : neurotomie du SPI (spasticité du triceps sural).
Les lésions microchirurgicales de la zone d'entrée dans la moelle des racines postérieures (Dorsal Root Entry Zone-tomy ou DREZ-tomie) et les rhizotomies dorsales sélectives, sont efficaces sur les réponses en flexion et les douleurs, en interrompant électivement les petites fibres nociceptives, sans altérer de façon importante la sensibilité superficielle. Elles s'adressent aux spasticités "régionales".
L'infusion intrathécale de baclofène permet de traiter les spasticité généralisées sévères et/ou douloureuses.
REFERENCESBibliographie
Pierrot-Deseilligny E, Pradat-Diehl P, Robain G. Physiopathologie de la spasticité. Ann Réadaptation Méd Phys 1993; 36:309-320.Delwaide PJ, Olivier E, Fornarelli M. Les myorelaxants. In: Doin (ed). Le médicament en neurologie, 1989.
Decq P. Traitement neurochirurgical de la spasticité. La lettre du neurologue 1999; 1:12-16.WEB
Le Cavorzin P. Pharmacologie de la spasticité musculaire. Cours du site de Pharmacologie de la Faculté de Médecine de Rennes.